Модуль 3. Геохимическая роль и основные биогеохимические
функции живого вещества
Тема 3.5. БИОГЕОХИМИЧЕСКИЕ ЦИКЛЫ ВАЖНЕЙШИХ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ:
УГЛЕРОДА,
КИСЛОРОДА, АЗОТА, СЕРЫ, ФОСФОРА, КАЛИЯ, КАЛЬЦИЯ,
КРЕМНЕЗЕМА, АЛЮМИНИЯ, ЖЕЛЕЗА,
МАРГАНЦА И ТЯЖЕЛЫХ МЕТАЛЛОВ
Давайте хотя бы в общих чертах познакомимся с биогеохимическими циклами таких
важных для биосферы элементов как углерод, кислород, азот, сера, фосфор, калий,
кальций, а также весьма распространенных в природе элементов, таких как кремний,
алюминий и железо. Биогеохимический цикл углерода. Содержание углерода в атмосфере Земли составляет 0,046% в форме двуокиси
углерода и 0,00012% в форме метана. Среднее его содержание в земной коре –
0,35%, а в живом веществе – около 18% (Виноградов, 1964). С углеродом тесно
связан весь процесс возникновения и развития биосферы, т.к. именно углерод
является основой белковой жизни на нашей планете, т.е. углерод является
важнейшим химическим компонентом живого вещества. Именно этот химический
элемент, благодаря своей способности образовывать прочные связи между своими
атомами, является основой всех органических соединений. Индекс биогенного обогащения почв по отношению к земной коре, а растений по
отношению к почвам составляет для углерода 100 и 1000 соответственно (Ковда,
1985). Основным резервуаром углерода в биосфере, из которого этот элемент заимствуется
живыми организмами для синтеза органического вещества, является атмосфера.
Углерод содержится в ней, главным образом, в форме диоксида СО2. Небольшая доля
атмосферного углерода входит в состав других газов – СО и различных
углеводородов, в основном метана СН4. Но они в кислородной атмосфере
неустойчивы, и вступают в химические взаимодействия с образованием, в конечном
счёте, того же СО2. Из атмосферы углерод усваивается автотрофными организмами-продуцентами
(растениями, бактериями, цианобионтами) в процессе фотосинтеза, в результате
которого, на основе взаимодействия с водой, формируются органические соединения
– углеводы. Далее, в результате процессов метаболизма, с участием веществ,
поступающих с водными растворами, в организмах синтезируются и более сложные
органические вещества. Они не только используются для формирования растительных
тканей, но также служат источником питания для организмов, занимающих очередные
звенья трофической пирамиды – консументов. Таким образом, по трофическим цепям,
углерод переходит в организмы различных животных. Возвращение углерода в окружающую среду происходит двумя путями. Во-первых – в
процессе дыхания. Суть процессов дыхания заключается в использовании организмами
окислительных химических реакций, дающих энергию для физиологических процессов.
Окисление органических соединений, для которого используется атмосферный или
растворённый в воде кислород, имеет результатом разложение сложных органических
соединений с образованием СО2 и Н2О. В итоге углерод в составе СО2 возвращается
в атмосферу, и одна ветвь круговорота замыкается. Второй путь возвращения углерода – разложение органического вещества. В условиях
биосферы процесс этот в основном протекает в кислородной среде, и конечными
продуктами разложения являются те же СО2 и Н2О. Но большая часть углекислого
газа при этом не поступает прямо в атмосферу. Углерод, высвобождающийся при
разложении органического вещества, в основном остаётся в растворённой форме в
почвенных, грунтовых и поверхностных водах. Или в виде растворённого углекислого
газа, или же в составе растворённых карбонатных соединений – в форме ионов НСО3-
или СО32-. Он может после более или менее продолжительной миграции частично
возвращаться в атмосферу, но большая или меньшая его доля всегда осаждается в
виде карбонатных солей и связывается в составе литосферы. Часть атмосферного углерода непосредственно поступает из атмосферы в гидросферу,
растворяясь в воде. Главным образом, углекислый газ поглощается из атмосферы,
растворяясь в водах Мирового Океана. Сюда же поступает и часть углерода, в тех
или иных формах растворённого в водах суши. СО2, растворённый в морской воде,
используется морскими организмами на создание карбонатного скелета (раковины,
коралловые постройки, панцири иглокожих и т.д.). Он входит в состав пластов
карбонатных пород биогенного происхождения, и на более или менее продолжительное
время «выпадает» из биосферного круговорота. В бескислородных средах разложение органического вещества также идёт с
формированием в качестве конечного продукта углекислого газа. Здесь окисление
протекает за счёт кислорода, заимствуемого из минеральных веществ
бактериями-хемосинтетиками. Но процесс в этих условиях идёт медленнее, и
разложение органического вещества обычно является неполным. В результате
существенная часть углерода остаётся в составе не до конца разложившегося
органического вещества и накапливается в толще земной коры в битуминозных илах,
торфяниках, углях. Хранители углерода – это живая биомасса, гумус, известняки и каустобиолиты.
Естественными источниками углекислого газа, кроме вулканических эксгаляций,
являются процессы разложения органичесекого вещества, дыхание животных и
растений, окисление органических веществ в почве и других природных средах.
Техногенная углекислота составляет 20х109 т, что пока намного меньше, чем
естественное ее поступление в атмосферу. За миллиарды лет с момента появления
жизни на Земле весь углерод атмосферы и гидросферы неоднократно прошел через
живые организмы. В течение всего 304 лет живые организмы усваивают столько
углерода, сколько его содержится в атмосфере. Следовательно, всего за 4 года
может полностью обновиться углеродный состав атмосферы, и условно можно считать,
что углерод атмосферы за этот срок завершает свой цикл. Цикл углерода, входящего
в состав гумуса почв оценивается в 300-400 лет. Роль углерода в биосфере наглядно иллюстрируется схемой его круговорота (рис.
3.5.1). 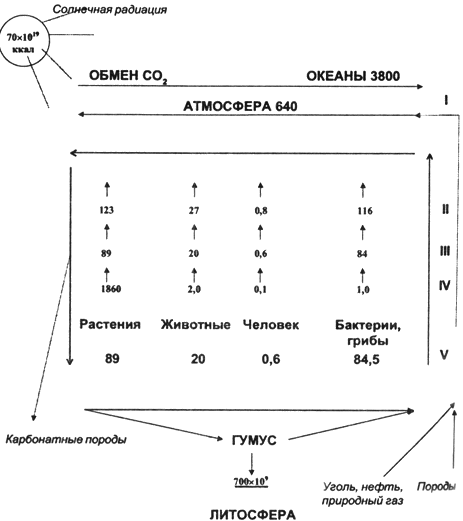
Рис. 3.5.1. Схема биогеохимического цикла углерода Из этой схемы наглядно видно, что растения, используя механизм фотосинтеза,
выполняют функцию продуцентов кислорода и являются основными потребителями
углекислого газа. Однако, цикл биологического круговорота углерода не замкнут. Что очень важно, в
том числе, и для нас. Этот элемент нередко выводится из геохимического
круговорота на длительный срок в виде карбонатных пород, торфов, сапропелей,
углей, гумуса. Таким образом, часть углерода всё время выпадает из
биологического круговорота, связываясь в литосфере в составе различных горных
пород. Почему же тогда не возникает дефицита углерода в атмосфере? Причина в
том, что его потеря компенсируется постоянным поступлением СО2 в атмосферу в
результате вулканической деятельности. То есть, в атмосферу постоянно поступают
глубинные углекислый газ и окись углерода. Это позволяет поддерживать баланс
углерода в биосфере нашей планеты. Хозяйственная деятельность человека интенсифицирует биологический круговорот
углерода и может способствовать повышению первичной, а, следовательно, и
вторичной продуктивности. Но дальнейшая интенсификация техногенных процессов и
может сопровождаться повышением концентрации двуокиси углерода в атмосфере.
Повышение концентрации углекислоты до 0,07% резко ухудшает условия дыхания
человека и животных. Расчеты показывают, что при условии сохранения современного
уровня добычи и использования горючих ископаемых потребуется чуть больше 200 лет
для достижения такой концентрации углекислого газа в атмосфере Земли. В
отдельных крупных городах эта угроза вполне реальна уже сейчас. Биогеохимический цикл кислорода Как Вы помните, кислород – самый распространенный элемент не только земной коры
(его кларк 47), но и гидросферы (85,7%), а также живого вещества (70%).
Существенную роль этот элемент играет и в составе атмосферы (более 20%).
Благодаря исключительно высокой химической активности, кислород играет особо
важную роль в биосфере. Он определяет окислительно-восстановительные и
щелочно-кислотные условия растворов и расплавов. Для него характерна как ионная,
так и неионная форма миграции в растворах. Эволюция геохимических процессов на Земле сопровождается неуклонным увеличением
содержания кислорода. В настоящее время количество кислорода в атмосфере
составляет 1,2х1015 тонн. Масштабы продуцирования кислорода зелеными растениями
таковы, что это количество могло быть удвоено за 4000 лет. Но этого не
происходит, так как в течение года разлагается примерно такое же количество
органического вещества, которое образуется в результате фотосинтеза. При этом
поглощается почти весь выделившийся кислород. Но благодаря незамкнутости
биогеохимического круговорота в связи с тем, что часть органического вещества
сохраняется и свободный кислород постепенно накапливается в атмосфере. Главная «фабрика» по производству кислорода на нашей планете – зеленые растения,
хотя в земной коре также протекают разнообразные химические реакциив результате
которых выделяется свободный кислород. Еще один миграционный цикл свободного кислорода связан с массобменом в системе
природные воды – тропосфера. В воде океана находится от 3х109 до 10х109 м3
растворенного кислорода. Холодная вода высоких широт поглощает кислород, а,
поступая с океаническими течениями в тропики – выделяет его в атмосферу.
Поглощение и выделение кислорода происходит и при смене сезонов года,
сопровождающихся изменением температуры воды. Кислород расходуется в громадном количестве окислительных реакций, большинство
из которых имеет биохимическую природу. В этих реакциях высвобождается энергия,
поглощенная в ходе фотосинтеза. В почвах, илах, водоносных горизонтах
развиваются микроорганизмы, использующие кислород для окисления органических
соединений. Запасы кислорода на нашей планете огромны. Он входит в состав
кристаллических решеток минералов и высвобождается из них живым веществом. Таким образом, общая схема круговорота кислорода в биосфере складывается из двух
ветвей:
- образование свободного кислорода при фотосинтезе;
- поглощение кислорода в окислительных реакциях
Согласно расчетам Дж. Уолкера (1980) выделение кислорода растительностью мировой
суши составляет 150х1015 тонн в год; выделение фотосинтезирующими организмами
океана – 120х1015 тонн в год; поглощение в процессах аэробного дыхания –
210х1015 тонн в год; биологическая нитрификация и другие процессы разложения
органического вещества – 70х1015 тонн в год. В биогеохимическом круговороте можно выделить потоки кислорода между отдельными
компонентами биосферы (рис. 3.5.2).
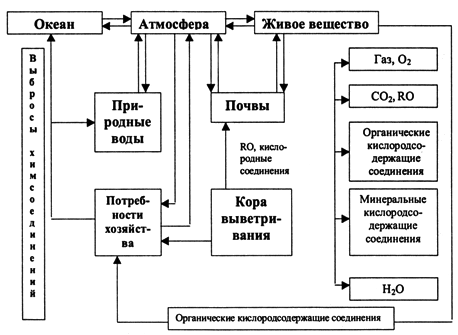 Рис. 3.5.2. Схема биогеохимического цикла кислорода В современных условиях установившиеся в биосфере потоки кислорода нарушаются
техногенными миграциями. Многие химические соединения, сбрасываемые
промышленными предприятиями в природные воды, связывают растворенный в воде
кислород. В атмосферу выбрасывается все большее количество углекислого газа и
различных аэрозолей. Загрязнение почв и, особенно, вырубка лесов, а также
опустынивание земель на огромных территориях уменьшают производство кислорода
растениями суши. Огромное количество атмосферного кислорода расходуется при
сжигании топлива. В некоторых промышленно развитых странах кислорода сжигают
больше, чем образуется его за счет фотосинтеза. Биогеохимический цикл водорода Содержание водорода в земной коре, в отличие от кислорода сравнительно невелико.
Большая часть атомов водорода здесь входит в состав воды, нефти, горючих газов,
некоторых минералов. Геохимия водорода тесно связана с историей воды и живого
вещества. Кларк водорода гидросферы – 2,72, а живого вещества – 10,5. В земной коре свободный водород неустойчив. Он быстро соединяется с кислородом,
образуя воду, а также участвует в других реакциях. Кроме того, в связи со своей
ничтожно малой атомной массой он способен улетучиваться в космос (диссипировать).
Значительное количество водорода поступает на поверхность Земли при
вулканических извержениях. Постоянно образуется газообразный водород и в
результате некоторых химических реакций, а также в процессе жизнедеятельности
бактерий, разлагающих органическое вещество в анаэробных условиях. Организмы закрепляют водород в биосфере планеты, связывая его не только в
органическом веществе, но и участвуя в фиксации водорода минеральным веществом
почвы. Это становится возможным в результате диссоциации кислотных продуктов
метаболизма с высвобождением иона Н+. Последний, как правило, образует с
молекулой воды посредством водородной связи ион гидроксония (Н3О+). При
поглощении иона гидроксония некоторыми силикатами происходит их трансформация в
глинистые минералы. Таким образом, как подчеркивал В.В. Добровольский,
интенсивность продуцирования кислотных продуктов метаболизма является важным
фактором гипергенного преобразования кристаллических горных пород и образования
коры выветривания. Из циклических процессов на поверхности Земли, в которых участвует водород, один
из наиболее мощных – круговорот воды: ежегодно через атмосферу проходит более
520 тысяч кубометров влаги. Для создания фитомассы Мировой суши, существовавшей
до вмешательства человека, по данным В.В. Добровольского (1998) было расщеплено
примерно 1,8х1012 тонн воды и, соответственно, связано 0,3х1012 тонн водорода.
В процессе круговорота воды в биосфере происходит разделение изотопов водорода и
кислорода. Пары воды при испарении обогащаются легкими изотопами, поэтому
атмосферные осадки, поверхностные и грунтовые воды также обогащены легкими
изотопами по сравнению с океаническими водами, имеющими устойчивый изотопный
состав. Биогеохимический цикл азота Азот и его соединения играют в жизни биосферы такую же важную и незаменимую
роль, как и углерод. Биофильность азота сравнима с биофильностью углерода.
Индекс биогенного обогащения почв по отношению к земной коре, а растений по
отношению к почвам составляет для азота 1000 и 10000 соответственно (Ковда,
1985). Основным резервуаром азота в биосфере также является воздушная оболочка. Около
80% всех запасов азота сосредоточено в атмосфере планеты, что связано с
направлением биогеохимических потоков соединений азота, образующихся при
денитрификации. Основной формой, в которой содержится азот в атмосфере, является
молекулярная – N2. В качестве несущественной примеси в атмосфере содержатся
различные оксидные соединения азота NOx, а также аммиак NH3. Последний в
условиях земной атмосферы наиболее неустойчив и легко окисляется. В то же время,
величина окислительно-восстановительного потенциала в атмосфере недостаточна и
для устойчивого существования оксидных форм азота, потому его свободная
молекулярная форма и является основной. Первичный азот в атмосфере, вероятно, появился в результате процессов дегазации
верхней мантии и из вулканических выделений. Фотохимические реакции в высоких
слоях атмосферы приводят к образованию соединений азота и заметному поступлению
их на сушу и в океан с атмосферными осадками (3-8 кг/га аммонийного азота в год
и 1,5-6 кг/га нитратного). Этот азот также включается в общий биогеохимический
поток растворенных соединений, мигрирующих с водными массами, участвует в
почвообразовательных процессах и в формировании биомассы растений. В отличие от углерода, атмосферный азот не может напрямую использоваться высшими
растениями. Поэтому ключевую роль в биологическом круговороте азота играют
организмы-фиксаторы. Это микроорганизмы нескольких различных групп, обладающие
способностью путём прямой фиксации непосредственно извлекать азот из атмосферы
и, в конечном счёте, связывать его в почве. К ним относятся:
- некоторые свободноживущие почвенные бактерии;
- симбионтные клубеньковые бактерии (существующие в симбиозе с бобовыми);
- цианобионты, которые также бывают симбионтами грибов, мхов, папоротников, а
иногда и высших растений.
В результате деятельности организмов – фиксаторов азота он связывается в почвах
в нитритной форме (соединения на основе NH3). Нитритные соединения азота способны мигрировать в водных растворах. При этом они
окисляются и преобразуются в нитратные – соли азотной кислоты HNO3. В этой форме
азотные соединения способны эффективно усваиваться высшими растениями и
использоваться для синтеза белковых молекул на основе пептидных связей C-N.
Далее, по трофическим цепям, азот попадает в организмы животных. В окружающую
среду (в водные растворы и в почву) он возвращается в процессах выделительной
деятельности животных или разложения органического вещества. Возврат свободного азота в атмосферу, как и его извлечение, осуществляется в
результате микробиологических процессов. Это звено круговорота функционирует
благодаря деятельности почвенных бактерий-денитрификаторов, вновь переводящих
азот в молекулярную форму. В литосфере, в составе осадочных отложений, связывается весьма небольшая часть
азота. Причина этого в том, что минеральные соединения азота, в отличие от
карбонатов, очень хорошо растворимы. Выпадение некоторой доли азота из
биологического круговорота также компенсируется вулканическими процессами.
Благодаря вулканической деятельности в атмосферу поступают различные
газообразные соединения азота, который в условиях географической оболочки Земли
неизбежно переходит в свободную молекулярную форму. Таким образом, основными специфическими чертами круговорота азота в биосфере
можно считать следующие:
- преимущественную концентрацию в атмосфере, играющей исключительную роль
резервуара, из которой живые организмы черпают запасы необходимого им азота;
- ведущую роль в круговороте азота почв и, в особенности, почвенных
микроорганизмов, деятельность которых обеспечивает переход азота в биосфере из
одних форм в другие (рис. 3.5.3).
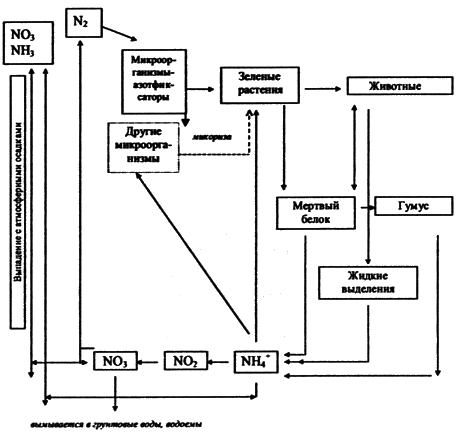 Рис. 3.5.3. Схема биогеохимического цикла азота Поэтому огромное количество азота в связанном виде содержит биосфера: в
органическом веществе почвенного покрова (1,5х1011 т), в биомассе растений
(1,1х109 т), в биомассе животных (6,1х107 т). В больших количествах азот
содержится и в некоторых биогенных ископаемых (селитры). В то же время наблюдается парадокс – при огромном содержании азота в атмосфере
вследствие чрезвычайно высокой растворимости солей азотной кислоты и солей
аммония, азота в почве мало и почти всегда недостаточно для питания растений.
Поэтому потребность культурных растений в азотных удобрениях всегда высока.
Поэтому ежегодно в почву вносится по разным оценкам от 30 до 35 млн. тонн азота
в виде минеральных удобрений. Таким образом, поступление за счет азотных
удобрений составляет 30% от общих поступлений азота на сушу и в океан. Это часто
приводит к существенному загрязнению окружающей среды и тяжелым заболеваниям
человека и животных. Особенно велики потери нитратных форм азота, так как он не
сорбируется почвой, легко вымывается природными водами, восстанавливается в
газообразные формы и до 20-40% его теряется для питания растений. Существенным
нарушением цикла азота является и все возрастающее количество отходов
животноводства, промышленных отходов и стоков больших городов, поступление в
атмосферу аммония и оксидов азота при сжигании угля, нефти, мазута и т.д. Опасно
проникновение оксидов азота в стратосферу (выхлопы сверхзвуковых самолетов,
ракет, ядерные взрывы), так как это может быть причиной разрушения озонового
слоя. Все это, естественно, сказывается на биогеохимическом цикле азота. Биогеохимический цикл серы Сера также является одним из элементов, играющих чрезвычайно важную роль в
круговороте веществ биосферы. Она относится к числу химических элементов,
наиболее необходимых для живых организмов. В частности, она является компонентом
аминокислот. Она предопределяет важные биохимические процессы живой клетки,
является незаменимым компонентом питания растений и микрофлоры. Соединения серы
участвуют в формировании химического состава почв, в значительных количествах
присутствуют в подземных водах, что играет решающую роль в процессах засоления
почв. Содержание серы в земной коре составляет 4,7х10-2%, в почве – 8,5х10-2%, в
океане – 8,8х10-2% (Виноградов, 1962). Однако, в засоленных почвах содержание
серы может достигать значений, измеряемых целыми процентами. Таким образом,
основным резервуаром, из которого она черпается живыми организмами, является
литосфера. Это обусловлено тем, что устойчивое существование сернистых
соединений в условиях современной атмосферы Земли, содержащей свободный кислород
и пары Н2О, невозможно. Сероводород (H2S) в кислородной среде окисляется, а
кислородные соединения серы, реагируя с Н2О, образуют серную кислоту H2SO4,
которая выпадает на поверхность Земли в составе кислотных дождей. Поэтому оксиды
серы SOх, хотя и могут усваиваться растениями непосредственно из атмосферы,
существенной роли в круговороте серы этот процесс не играет. Сера имеет несколько изотопов, из которых в природных соединениях наиболее
распространены S32 (>95%) и S34 (4,18%). В результате биологических и
биогеохимических процессов происходит изменение в соотношении этих изотопов в
сторону увеличения содержаний более легкого изотопа в верхних гумусовых
горизонтах почв. Изотопный состав серы подземных, почвенно-грунтовых вод и водорастворимых
сульфатов из горизонта С сульфатно-содовых солончаков является сходным. В составе земной коры соединения серы существуют, в основном, в двух минеральных
формах: сульфидной (соли сероводородной кислоты) и сульфатной (соли серной
кислоты). Редко встречается самородная сера, которая неустойчива и склонна, в
зависимости, от значений окислительно-восстановительного потенциала среды,
формировать или кислородные, или водородные соединения. Первичной, глубинной по происхождению, минеральной формой нахождения серы в
земной коре, является сульфидная. Сульфидные соединения в условиях биосферы
практически нерастворимы, и потому сульфидная сера растениями не усваивается.
Но, в то же время, сульфиды в кислородной среде неустойчивы. Поэтому сульфиды на
земной поверхности, как правило, окисляются, и в результате этого сера входит в
состав сульфатных соединений. Сульфатные соли обладают достаточно хорошей
растворимостью, и сера в географической оболочке активно мигрирует в водных
растворах в составе сульфат-иона SO42-. Именно в этой, сульфатной форме сера, в составе водных растворов, эффективно
усваивается растениями, а далее – животными организмами. Усвоению способствует
то, что сульфатные соединения серы способны накапливаться в почвах, участвуя в
процессах обменной сорбции и входя при этом в состав почвенного поглощающего
комплекса (ППК). Разложение органического вещества в кислородной среде приводит к возвращению
серы в почву и природные воды. Сульфатная сера мигрирует в водных растворах, и
может снова использоваться растениями. Если же разложение идёт в бескислородной
среде, ведущую роль играет деятельность серобактерий, которые восстанавливают
SO42- до H2S. Сероводород выделяется в атмосферу, где окисляется и возвращается
в другие компоненты биосферы в сульфатной форме. Часть серы в восстановительной
обстановке может связываться в сульфидных соединениях, которые, при
возобновлении доступа кислорода, снова окисляются и переходят в сульфатную
форму. Биогеохимический цикл серы состоит из 4 стадий (рис. 3.5.4 ):
- усвоение соединений серы живыми организмами (растениями и бактериями) и
включение серы в состав белков и аминокислот.
- Превращение органической серы живыми организмами (животными и бактериями) в
конечный продукт – сероводород.
- Окисление минеральной серы живыми организмами (серобактериями, тионовыми
бактериями) в процессе сульфатредукции. На этой стадии происходит окисление
сероводорода, элементарной серы, ее тио- и тетрасоединений.
- Восстановление минеральной серы живыми организмами (бактериями) в процессе десульфофикации до сероводорода. Таким образом, важнейшим звеном всего
биогеохимического цикла серы в биосфере является биогенное образование
сероводорода.
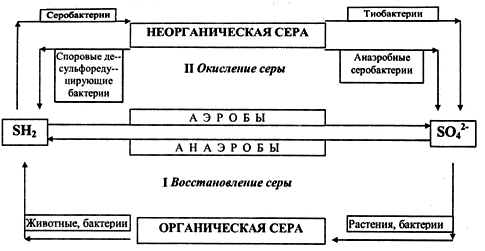 Рис. 3.5.4. Схема биогеохимического цикла серы Изъятие серы из биосферного круговорота происходит в результате накопления
сульфатных отложений (в основном гипсовых), слои и линзы которых становятся
компонентами литосферы. Компенсируются потери во-первых, в процессах вулканизма
(поступление H2S и SOx в атмосферу, а оттуда, с атмосферными осадками – на
поверхность Земли). А во-вторых, в результате деятельности термальных вод, с
которыми в верхние горизонты земной коры и на дно Мирового океана поступают
сульфидные соединения. Таким образом, к характерным особенностям круговорота серы можно отнести
второстепенную роль процессов атмосферной миграции, а также многообразие форм
нахождения, обусловленное переходом её из сульфидных форм в сульфатные и
обратно, в зависимости от изменения окислительно-восстановительных условий. Промышленные процессы выносят в атмосферу большое количество серы. В отдельных
случаях значительная концентрация соединений серы в воздухе служит причиной
нарушений в окружающей среде, в том числе, кислотных дождей. Присутствие в
воздухе двуокиси серы негативно влияет как на высшие растения, так и на
лишайники, причем эпифитные лишайники могут служить индикаторами повышенных
содержаний серы в воздухе. Лишайники поглощают влагу из атмосферы всем
слоевищем, поэтому концентрация серы в них быстро достигает предельно
допустимого уровня, что ведет к гибели организмов. Поступление серы в общий круговорот по данным Дж. П. Френда (1976) следующее: При дегазации земной коры – 12х1012 г/год; при выветривании осадочных пород –
42х1012 г/год,; антропогенные поступления в виде сернистого газа – 65х1012
г/год, что в сумме составляет 119х1012 г/год. Значительные количества серы
ежегодно консервируются в виде сульфидов и сульфатов – 100х1012 г/год и , таким
образом., временно выводятся из общего биогеохимического круговорота. Таким образом, антропогенное поступление серы в биосферу существенно изменяет
круговорот этого элемента, а приход серы в биосферу превышает ее расход, в
результате чего, должно происходить постепенное ее накопление. Биогеохимический цикл фосфора. Круговорот фосфора в природе сильно отличается от биогеохимических циклов
углерода, кислорода, азота и серы, так как газовая форма соединений фосфора
(например РН3) практически не участвует в биогеохимическом цикле фосфора. То
есть фосфор к накоплению в атмосфере вообще не способен. Поэтому роль
«резервуара» фосфора, из которого этот элемент извлекается и используется в
биологическом круговороте, так же как и для серы, играет литосфера. Фосфор в литосфере содержится в форме фосфатных соединений (солей фосфорной
кислоты). Основная доля среди них приходится на фосфат кальция – апатит. Это
полигенный минерал, образующийся в различных природных процессах – как в
глубинных, так и в гипергенных (в том числе и биогенных). Фосфатные соединения
способны растворяться в воде, и фосфор в составе иона РО43- может мигрировать в
водных растворах. Из них фосфор и усваивается растениями. Индекс биогенного обогащения почв по отношению к земной коре, а растений по
отношению к почвам составляет для фосфора, так же, как и для азота 1000 и 10000
соответственно (Ковда, 1985). Для растений наиболее доступным является фосфор
неспецифических органических соединений и гумуса и именно он играет главную роль
в малом (локальном) биологическом цикле фосфора. Животные являются еще большими концентраторами фосфора, чем растения. Многие из
них накапливают фосфор в составе тканей мозга, скелета, панцирей.. Есть
несколько способов усвоения фосфора организмами-консументами. Во-первых, прямое
усвоение из растений в процессе питания. Во-вторых, водные организмы-фильтраторы
извлекают фосфор из органических взвесей. В-третьих, органические соединения
фосфора усваиваются организмами-илоедами при переработке ими биогенных илов. Возврат фосфора в окружающую среду происходит при разложении органического
вещества. Но возврат этот оказывается далеко не полным. В целом для соединений
фосфора характерна тенденция выноса в форме водных растворов и взвесей в
конечные водоёмы стока, в наибольшей мере – в Мировой Океан, где он и
накапливается в составе осадочных отложений различного генезиса. Вновь вернуться
в экзогенный круговорот эта часть фосфора может только в результате
тектонических процессов, растягивающихся на сотни миллионов лет. В естественных
условиях сохранение баланса обеспечивается сравнительно слабой подвижностью
соединений фосфора, в результате которой фосфор, извлечённый растениями из
почвы, большей частью возвращается в неё в результате разложения органического
вещества. В почвах и породах фосфор достаточно легко фиксируется. Фиксаторами
фосфора являются гидроксиды железа, марганца, алюминия, глинистые минералы
(особенно, минералы группы каолинита). Однако, фиксированный фосфор может быть
на 40-50% десорбирован и использован растениями. Этот процесс зависит от рН и Eh
условий среды. Повышенная кислотность, образование угольной кислоты,
способствуют десорбции фосфора, усилению миграции фосфорных соединений. В восстановительной среде образуются соединения фосфора с двухвалентным железом,
что тоже способствует выносу фосфора из почвы. Миграция фосфора возможна и за счет водной и ветровой эрозии. Поэтому
биогеохимический цикл фосфора значительно менее замкнут и менее обратим, чем
циклы углерода и азота, а загрязнение фосфором окружающей среды особенно опасно
(рис. 3.5.5).
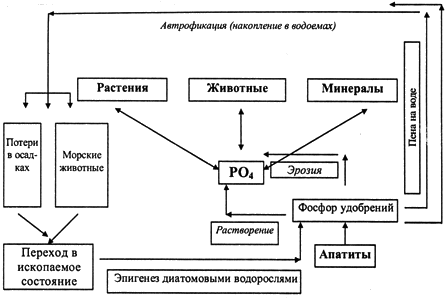 Рис. 3.5.5. Схема биогеохимического цикла фосфора Основными особенностями круговорота фосфора, таким образом, являются:
- отсутствие атмосферного переноса;
- наличие единственного источника – литосферы;
- тенденция к накоплению в конечных водоёмах стока.
При интенсивной сельскохозяйственной эксплуатации земель потери фосфора в
ландшафте становятся практически необратимыми. Компенсация возможна только за
счёт применения фосфорных удобрений. Известно, что фосфорные удобрения являются
важным и необходимым звеном в получении высоких урожаев сельскохозяйственных
культур. Однако, все известные запасы месторождений фосфатов ограничены и по
предсказаниям ученых могут истощиться уже в ближайшие 75-100 лет. В то же время,
вредные соединения фосфатов в последнее время становятся одним из важнейших
факторов загрязнения речных и озерных вод. Таким образом, в последе время общая картина распределения им миграции фосфора в
биосфере резко нарушена человеком. Вот слагаемые этого явления: во-первых,
мобилизация фосфора из агроруд и шлаков, производство и применение фосфорных
удобрений, во-вторых производство фосфорсодержащих препаратов и их использование
в быту; в-третьих – производство фосфорсодержащих ресурсов продовольствия и
кормов, вывоз и потребление их в зонах концентрации населения; в-четвертых –
развитие рыбного промысла, добыча морских моллюсков и водорослей, что влечет за
собой перераспределение фосфора из океана на сушу. В итоге наблюдается процесс
фосфатизации суши, но процесс этот проявляется крайне неравномерно.
Увеличивается содержание фосфора в окружающей среде больших городов. Напротив,
страны, активно экспортирующие органические продукты и не применяющие фосфорных
удобрений, теряют запасы фосфора в своих почвах. Биогеохимические циклы калия и натрия Кларк калия в земной коре составляет 2,89, а натрия 2, 46, т.е их относительные
содержания очень близки. Калий состоит из смеси 3-х изотопов: 39К – 93,08%;
40К -0,0119%; 41К – 6,91%.
Изотоп 40К неустойчив и превращается в соседние изобары кальция и аргона. Превращение калия в аргон явилось основой для разработки калий-аргонового метода
ядерной геохронологии. Космическая распространенность калия, как элемента нечетного, невелика по
сравнению с четными кальцием и кислородом. По размерам ион калия наиболее
крупный среди других ведущих катионов литосферы. Поэтому объемный кларк калия
занимает второе место после кислорода в земной коре. Калий – химически активный металл, в самородном состоянии не встречается. Во
всех химических соединениях на Земле выступает как одновалентный металл.
Металлический калий на воздухе «сгорает», быстро окисляясь до К2О. Число
минеральных видов – 115 (втрое меньше, чем у кальция и вдвое меньше, чем у
натрия).. Важнейшие минералы: галоиды – сильвин, карналлит, нитраты – К-селитра,
силикаты – К-полевые шпаты (ортоклаз, микроклин), флогопит, мусковит, биотит,
глауконит, лейцит. По химическим свойствам калий близок к натрию, что определяет
их совместную миграцию. Но их поведение в зоне гипергенеза и биосфере в целом
резко различно. Большая часть калия в ходе гипергенного преобразования силикатов
остается в составе вторичных глинистых минералов, поэтому калий гораздо прочнее
удерживается в пределах Мировой суши, чем натрий и ,как мы увидим далее,
кальций. И все же частичное высвобождение ионов калия в процессах гипергенеза
происходит и он активно вовлекается в биогеохимический круговорот. Обусловлено это тем, что калий играет очень важную роль в жизни живых
организмов. В условиях влажного климата при выветривании калийсодержащих
минералов калий легко выщелачивается и переносится водными растворами. Однако
вынос калия в коре выветривания происходит менее интенсивно, чем кальция и
натрия. Это связано с тем, что крупный ион калия в большей степени сорбируется
тонкодисперсными минералами. Давно известно, что ионы калия легче сорбируются и
некоторыми коллоидами (например, гидроокислами железа и алюминия), чем ионы
натрия. Реакции катионного обмена с глинистыми минералами также способствуют
фиксации калия. В почвах также происходит обмен между ионами калия и
гидроксония, которые имеют сопоставимые ионные размеры. Таким способом калий
может фиксироваться в гидрослюдах, каолините, монтмориллоните. Калий в большей
степени, чем натрий, поглощается наземной растительностью. Поэтому значительная часть калия сохраняется в почвах, в то время как большая
часть натрия выносится в океан. В составе стока с материков натрия почти в 2,5
раза больше, чем калия. Калий – важнейший элемент живых организмов. Они содержат от 0,1 до 0,01% калия.
В золе культурных растений до 25-60% К2О. Некоторые организмы способны
концентрировать калий в значительных количествах. Так, в некоторых водорослях
содержание калия достигает 3% живой массы. Наземные растения поглощают калий из
почвы. При недостатке калия листья бледнеют и отмирают, семена теряют всхожесть.
Калий легко проникает в клетки организмов и увеличивает их проницаемость для
различных веществ. Он оказывает значительное влияние на обмен веществ и
необходим растениям для фотосинтеза.. Кроме того, калий улучшает поступление
воды в клетки растений и понижает процесс испарения, тем самым увеличивая
устойчивость растений к засухе. При недостатке или избытке калия интенсивность
фотосинтеза снижается, а интенсивность дыхания повышается. Недостаток калия в
почвах приводит к значительному снижению урожайности растений. Именно поэтому кларк калия в живом веществе такой же высокий, как у азота.
Особенно много калия накапливают некоторые морские водоросли (до 5%). В биологический круговорот на суше вовлекается ежегодно около 1,8х109 тонн калия
(Добровольский, 1998). Освобождающаяся из системы биологического круговорота на
суше масса калия частично задерживается в мертвом органическом веществе и
сорбируется минеральным веществом почвы (глинистыми минералами), а частично
вовлекается в водную миграцию. Количество калия в настоящее время связанное в мертвом органическом веществе
педосферы составляет по данным разных авторов от 3х109 до 6х109 тонн. Ежегодно с
континетальным водным стоком в океан поступает более 61х106 тонн калия в
растворенном состоянии (виде свободных ионов) и 283х106 тонн калия в составе
взвесей (глинистые частицы, органическое вещество и т.д.). Калий активно
мигрирует также в системе поверхность океана-атмосфера в составе аэрозолей:
средняя концентрация этого элемента в атмосферных осадках над океаном - 15%.
Концентрация калия в атмосферных осадках над континентами заметно выше, в
среднем 0,7%. Значительное количество калия переносится с пылью с суши в океан.
По оценке В.В. Добровольского эта величина составляет не менее 43х106 тонн в
год. В гипергенной зоне крупные концентрации калия встречаются редко и представлены
эвапоритами – сильвином и карналлитом. Еще реже встречаются нитраты калия в виде
калиевой селитры органогенного происхождения (образуется в условиях аридного
климата). Кларк натрия в живом веществе очень низок – 0,008 (более чем на два порядка
ниже, чем у калия), что свидетельствует о низком потреблении натрия живым
веществом. Однако, в малых количествах натрий необходим всем живым организмам.
В условиях влажного климата натрий легко выходит из биологического круговорота и
выносится с жидким стоком за пределы ландшафта. В результате наблюдается общее
обеднение последнего натрием. Содержание натрия в растительных организмах обычно
очень низкое. Животные организмы нуждаются в повышенных количествах этого
элемента., так как он входит в состав крови. Влияет на деятельность
сердечно-сосудистой системы и почек. Поэтому животные иногда нуждаются в
подкормке поваренной солью. В сухом климате натрий концентрируется в грунтовых и озерных водах и
накапливается в солончаковых почвах (действие испарительного барьера).
Соответственно, и растительность галофитных сообществ содержит повышенные
количества натрия. Тем не менее, роль биологического круговорота натрия, в отличие от калия,
сравнительно невелика. Зато очень значительна его водная миграция. По
особенностям миграции в биосфере натрий весьма схож с хлором. Он образует легко
растворимые соли, поэтому накапливается в Мировом океане, участвует в
атмосферной миграции. Основной источник подвижного натрия в биосфере – выветривающиеся изверженные
породы (основной источник хлора – вулканизм). Техногенез внес существенные коррективы в биогеохимические пути миграции натрия.
Основное значение имеет добыча галита (поваренной соли), соды и мирабилита. На
характер биогеохимических циклов натрия существенное влияние оказывает и
орошение земель в засушливых районах. Биогеохимические циклы кальция и магния. Атомы кальция содержат магическое число протонов: 20 в ядре и это определяет
прочность его ядерной системы. Среди легких элементов кальций представлен
максимальным числом стабильных изотопов – 6, имеющих распространение: 40Са –
96,97% (дважды магический Z=N=20) 42Са – 0,64, 43Са – 0,145,
44Са – 2,06,
46Са-0,0033, 48Са -0,185%. По распространению в Солнечной системе он занимает 15
место, но среди металлов находится на 5 месте. В природе он ведет себя как химически активный металл. Легко окисляется с
образованием СаО. В геохимических процессах выступает как двухзарядный катион
Са+2 Его ионный радиус очень близок к радиусу натрия. Число минеральных видов – 390,
поэтому он относится к главным минералообразующим элементам. По числу образуемых
минералов он занимает 4 место после кислорода, водорода и кремния. Например:
карбонаты – кальцит, арагонит, доломит; сульфаты – ангидрит, гипс; галоиды-
флюорит; фосфаты: апатит; силикаты – гранаты, пироксены, амфиболы, эпидот,
плагиоклазы, цеолиты. Плагиоклазы – наиболее распространенные минералы земной коры. Кларк кальция в
литосфере составляет 2,96. Кальциевые силикаты слабо устойчивы в зоне
гипергенеза и при выветривании горных пород разрушаются в первую очередь. Кальций обладает относительно высокой миграционной способностью, во многом
определяемой особенностями климата. В процессах химического выветривания кальций
выщелачивается из минералов природными водами. По отношению к выветриванию
кальциевые минералы образуют следующую последовательность: плагиоклаз –
кальциевый авгит- кальциевый амфибол. В группе плагиоклазов богатые кальцием
разности выветриваются скорее, чем натриевые. При этом природные растворы,
энергично удаляющие кальций, содержат значительные количества гидрокарбонатного
иона. Зато в почвах гумидных зон наблюдается значительный дефицит кальция. Очень
мало его и в корах выветривания. Объясняется это высокой миграционной
подвижностью данного элемента. В ионном стоке с материков кальций занимает первое место среди катионов. Реками
он выносится главным образом в виде взвесей карбонатов, сульфатов и бикарбоната
в растворенном состоянии. Геохимическая история кальция в океане связана с
карбонатной системой равновесия, температурой воды и деятельностью живых
организмов. Кальций – один из важнейших элементов живых организмов – от простейших до высших
млекопитающих. Холодные воды высоких широт и морские глубины недосыщены СаСО3
из-за низких температур и рН, поэтому содержащаяся в воде угольная кислота
растворяет СаСО3 донных отложений. Именно поэтому морские организмы в высоких
широтах избегают строить свои скелеты из СаСО3. В экваториальных широтах
установлена область пересыщения СаСО3. Здесь наблюдается массовый рост
коралловых рифов, у многих живущих здесь организмов массивные карбонатные
скелеты и раковины. Миграция кальция в океане с участием живых организмов – наиболее важное звено в
его круговороте. По А.П. Виноградову реки ежегодно приносят в океан и1*1015т
СаСО3. Куда же он делся?. Примерно столько же его ежегодно захороняется в донных
отложениях океана. Живые организмы океана концентрируют кальций в виде арагонита
и кальцита. Арагонит, однако, неустойчив и со временем переходит в кальцит. В
океане мы сталкиваемся с уникальными явлениями быстрого роста крупных кристаллов
в отдельных организмах. В некоторых раковинах двустворчатых моллюсков
встречаются кристаллы кальцита длиной более 7 см, в тропических морях обитают
морские ежи , имеющие длинные иголки из кальцита. У многих иглокожих наблюдается
адаптация живого тела организмов к форме кристаллов. В этом случае мы встречаем
особый вид симбиоза между организмами и кристаллами. . В аридном климате кальций легко выпадает из растворов в виде карбонатов,
формируя толщи хемогенных карбонатных пород и иллювиально-карбонатные горизонты
в почвах. Небольшая часть ионов кальция морской воды осаждается в замкнутых водоемах в
эвапоритовых условиях химическим путем. Кальций играет важную роль в процессах почвообразования. Он входит в состав
почвенно-поглощающего комплекса, участвует в обменных реакциях почвенного
раствора, обусловливая буферную способность почв в кислом интервале среды.
Гуматы кальция играют важную роль в формировании структуры почвы. Кроме того,
кальций активно участвует в процессах осаждения полуторных окислов, марганца,
нередко образуя конкреции совместно с этими элементами и кремнеземом. В почвах кислого ряда, характеризующихся значительным проявлением процесса
выщелачивания, наблюдается явление биогенного накопления кальция в подстилке и
аккумулятивных поверхностных горизонтах почв. Он входит в группу
элементов-биофилов. Поэтому кальций активно участвует в биологическом
круговороте. Масштабы вовлечения кальция значительно различаются в разных
природных зонах. В агроландшафтах значительная часть кальция отчуждается вместе с урожаем. Но нарушение биогеохимического круговорота кальция в настоящее время происходит
не только и не столько за счет отчуждения части его с сельскохозяйственной
продукцией, но и за счет использования карбонатных пород в строительстве,
сельском хозяйстве (известкование почв), металлургической промышленности. Клак магния уступает кларку кальция и составляет 1,87, но распределение магния
очень неоднородно. По размеру ион магния близок к ионам двухвалентного железа и
никеля и совместно с ними входит в состав оливинов и пироксенов, концентрируясь
в основных и особенно ультраосновных магматических горных породах. В то же время, магний накапливается в океане и соляных озерах и помиграционной
способности приближается к таким элементам как натрий и калий. Обусловлено это
хорошей растворимостью хлоридов и сульфатов магния. В отличие от других
щелочноземельных и щелочных металлов магний, благодаря малому размеру ионов,
легко входит в кристаллическую решетку глинистых минералов, образуя вторичные
магнезиальные алюмосиликаты. Магний – биофильный элемент. Он входит в состав хлорофилла, который при
недостатке этого элемента разрушается. Растение реагирует на недостаток магния в
почве оттоком хлорофилла из старых листьев к молодым. Передвижение идет по
жилкам листа. Поэтому они долгое время остаются зелеными, в то время как
межпрожилковые участки листа желтеют. Известны и болезни животных. Связанные с
недостатком магния. Тем не менее, биофильность магния меньше, чем у кальция и
калия. В гумидных ландшафтах магний, как и кальций выщелачивается из почв, хотя его
подвижность ниже. Чем у кальция. Связано это с действием нескольких
геохимических барьеров. Во-первых, магний активно поглощается живым веществом;
во- вторых – он, так же как и калий входит в кристаллические решетки вторичных
силикатов и, наконец, сорбируется глинистыми коллоидами и гумусом. Все же
значительная часть магния выносится с жидким стоком и в составе грунтовых и
речных вод магний находится на втором месте после кальция. В аридных условиях на распределение магния влияет высокая растворимость его
хлоридов и сульфатов. В результате наблюдается накопление этих солей на
испарительных барьерах и формирование солончаков. В океан магний попадает из выветривающихся горных пород и масштабы этого
поступления значительны (особенно. В прошлом). По подсчетам В.М. Гольдшмидта за
время геологической истории с материков в океан поступило 12,6 г магния на
каждый килограмм океанической воды. Однако. Содержание магния в воде современных
океанов составляет всего 1,3 г. Это обусловлено многократным участием каждого
атома магния в большом геологическом круговороте, отложением доломитов и других
содержащих магний осадочных пород. Миграция магния на протяжении геологической истории существенно менялась. Если в
докембрийских известняках содержится до 12,6% магния, то в современных – только
1%. Образование доломитов в открытых морях прекратилось еще в конце палеозоя. В
настоящее время доломиты осаждаются только в некоторых лагунах. Технофильность магния пока значительно ниже, чем у кальция и натрия. До начала
ХХ века использовались только доломит и магнезит. Только в последнее время стали
широко использовать сплавы, содержащие магний. В обедненных магнием ландшафтах
наблюдается незначительное его накопление за счет внесения магнийсодержащих
удобрений и известкования почв с применением доломита. Таким образом, в целом для биогеохимических циклов всех щелочных и
щелочноземельных металлов характерна незамкнутость глобальных годовых циклов. В
результате наблюдается интенсивная аккумуляция этих элементов в осадках Мирового
океана: до 99% кальция, 98% калия и свыше 60% натрия сосредоточено по данным
В.В. Добровольского в осадочных породах. Биогеохимический цикл кремния. Кремний является вторым по распространенности (после кислорода) химическим
элементом в земной коре. Его кларки в земной коре – 29,5, в почве – 33, в океане
– 5х10-5. Однако, несмотря на огромную распространенность кремния и его
соединений в природе (кварц и силикаты составляют 87% литосферы),
биогеохимические циклы кремния (особенно на суше) изучены еще недостаточно. Содержание кремнезема в водах современных озер и рек составляет 10-30 мг/л, а в
морской воде еще меньше – 0Ю5-3 мг/л, то есть он присутствует в виде резко
ненасыщенного раствора. Это связано с тем. Что кремний непрерывно поглощается из
воды живыми организмами. Недаром В.И. Вернадский считал, что никакой организм в биосфере не может
существовать без кремния, необходимого для образования клеток и тканей растений
и животных, их скелетов. Живое вещество извлекает кремний из природных вод и
почв для питания и функционирования биохимических процессов, высвобождая его
затем с экскрементами и при отмирании. В результате отмирания миллиардов
организмов огромные массы кремнезема откладываются на дне водоемов. Так
формируется биогеохимический цикл кремния. В.И. Вернадский подчеркивал, что
историю кремнезема нельзя понять без изучения результатов жизнедеятельности
организмов. М.Страхов доказал возможность исключительно биогенного извлечения SiO2 из
поверхностных вод. Однако, поступление растворенного кремнезема в океан с суши
недостаточно для нормального развития фитопланктона. Именно поэтому в умеренных
и тропических широтах в океане слабо развиты организмы с кремнистым скелетом.
При существующей насыщенности воды кремнеземом для нормального развития
фитопланктона диатомовых водорослей каждый атом кремния должен в течение года
использоваться многократно (десятки и даже сотни раз). Из всей массы кремнезема,
продуцированного в поверхностном фотосинтезирующем слое, донных отложений
достигает не более 0,1части, а нередко это только 0,05-0,01 часть. Остальной
кремнезем снова переходит в водорастворимое состояние. В дальнейшем, он
захватывается из воды новыми поколениями диатомовых водорослей, кремнистых губок
и радиолярий. Тем не менее, доходящая до дна 0,1-0,01 часть остатков скелетов
диатомового планктона приводит к значительным по масштабам накоплениям осадочных
кремнистых пород. Эта ветвь кругооборота кремния относительно статична и
необратима и часть кремнезема именно таким путем выводится из биогеохимического
круговорота. Для нас важнее другая, более динамичная ветвь круговорота, которая и является
собственно цикличной. Это тот кремний, который много раз за год переходит из
организмов фитопланктона в окружающую среду и обратно. В этих переходах
проявляется наиболее важная функция водного биогеохимического цикла кремния –
функция массо- и энергопереноса вещества из поверхностных более глубокие зоны
Мирового океана. Вторая особенность биогеохимического цикла кремния в Мировом океане – его
неразрывная связь с углеродом. Континентальная ветвь круговорота кремния сложна. Водная миграция кремнезема
тесно связана с ландшафтно-геохимическими условиями: составом растительности, и
литологией подстилающих отложений. Подвижность кремнезема резко возрастает с
увеличением рН среды, особенно, в щелочном интервале. При рН=10-11 концентрация
кремнезема может достигать 200 мг/л. Сильно увеличивает растворимость аморфного
кремнезема и повышение температуры. Сульфаты, бикарбонаты и карбонаты магния и
кальция резко снижают растворимость кремнезема и вызывают его осаждение. В
условиях сильнокислой среды рН=1-2 растворимость кремнезема также сильно
повышается. Некоторые растения являются концентраторами кремния. Мощным механизмом, приводящим в движение этот круговорот является растительный
покров суши, в котором происходят разнообразные процессы образования содержащих
кремний органогенных минералов (биолитов). Под биолитами в данном случае
понимаются минералы, образующиеся внутри организма в процессе его
жизнедеятельности. Их роль в круговороте кремния чрезвычайно велика, но изучена
недостаточно. В основном, кремнезем инкрустирует клеточные оболочки. Больше
всего биолитов кремнезема содержат злаки, осоки, хвощи, папоротники, мхи,
пальмы, хвоя сосен, елей, листья и кора вяза, осины, дуба. В золе ковылей
содержание кремнезема по данным Парфенова и Ярилова может достигать 80%. В
стволах бамбука иногда обнаруживаются образования, сложенные опалом, достигавшие
в длину 4 см и имевшие массу до 16 г! Генезис почвенной кремнекислоты в
некоторых условиях напрямую связан с накоплением этого элемента живыми
организмами. Наиболее яркий пример – образование солодей, кремнекислота которых
накапливалась благодаря деятельности диатомовых водорослей. В процессе
жизнедеятельности сине-зеленых водорослей происходит «захват» железа, марганца и
кремнезема с образованием биолитов. Соотношение процессов накопления и выноса
кремнезема в условиях умеренной зоны сдвинуто в сторону накопления. Растительный
покров суши, особенно хвойные леса, выступает как мощный механизм,
перекачивающий массы кремнезема из горных пород, почв и природных вод, и
возвращающий их снова в ландшафт в форме биолитов. В дальнейшем опал биолитов
переходит в халцедон и даже во вторичный кварц. Значительная же часть
кремнекислоты биолитов включается в активную миграцию в почвенно-грунтовых водах
в форме коллоидных и истинных растворов. В результате воздействия аэрозолей кремнезема на живые организмы (животные и
человек) развивается серьезное заболевание – силикоз. Биогеохимические циклы алюминия, железа и марганца Как Вы уже знаете, алюминий один из трех наиболее распространенных элементов
земной коры. Его кларк – 8,05. Железо по распространенности занимает второе
место после алюминия среди металлов и четвертое среди всех элементов земной
коры. Его кларк составляет 4,65. Содержание марганца в земной коре значительно
ниже -0,1%. Эти два элемента занимают соседние места в периодической системе
элементов Д.И. Менделеева и имеют сходное строение электронных оболочек. Однако
марганец мигрирует более активно, т.к. значение рН, при котором выпадает в
осадок его гидроксид, выше, чем для железа. Железо и марганец активно
вовлекаются в биологический круговорот, так как входят в состав многих
ферментов. Железо участвует в образовании хлорофилла и входит в состав
гемоглобина. Марганец принимает участие в окислительно-восстановительных реакций
– дыхании, фотосинтезе и усвоении азота. Участие алюминия в биологическом
круговороте ограничено. Хотя в земной коре это самый распространенный металл,
биофильность его очень низкая, кларк живого вещества всего 5х10-3. Биогеохимичекие циклы железа и марганца в решающей степени зависят от условий
увлажнения, реакции среды, степени аэрации почвы, условий разложения
органического вещества. Миграция алюминия в меньшей степени зависит от
окислительно-восстановительных условий, так как он обладает постоянной
валентностью. В то же время, амфотерность этого элемента обуславливает сильную
зависимость его миграции от кислотно-основных условий среды: в сильно кислой
среде он ведет себя как катион, а в сильно щелочной – как анион. В нейтральных и
слабощелочных водах степей и пустынь он почти не мигрирует, наиболее высока
подвижность этого металла в сильно кислых водах районов активного вулканизма и
зон окисления сульфидных месторождений. Под защитой органических коллоидов
алюминий активно мигрирует в болотных водах. Тем не менее, интенсивность
миграции алюминия в целом значительно ниже, чем у железа и марганца, а его
минералы более устойчивы. Слабая подвижность алюминия определяет остаточное (за
счет выноса более подвижных элементов) накопление его гидроксидов в коре
выветривания влажных тропиков и образование бокситов. Известно, что соединения алюминия, железа и марганца в почвах с промывным
режимом мигрируют в вертикальном направлении и образуют иллювиальные горизонты,
обогащенные полуторными окислами и марганцем. Многими исследователями доказано,
что миграция полуторных окислов в условиях промывного типа водного режима
происходит в виде высокодисперсных золей, стабилизированных кислым гумусом. При
этом немаловажную роль играет создание анаэробной обстановки, обуславливающей
образование соединений двухвалентного железа и марганца. Решающее значение имеют
агрессивные фульвокислоты, разрушающие почвенные минералы и образующие с
алюминием, железом и марганцем легкоподвижные комплексные соединения. Соединения железа и марганца активно мигрируют с боковым внутрипочвенным стоком,
образуя скопления конкреций в болотах. Луговых и глеевых почвах, мелководных
озерах и лагунах. Это свидетельствует о способности этих соединений мигрировать
на весьма большие расстояния. Осаждение железа в аккумулятивных ландшафтах
происходит в виде карбонатов железа, окислов разной степени гидратированности, а
также фосфатов и гуматов. В степях и пустынях в условиях щелочной среды эти
элементы мигрируют слабо. Миграция железа и марганца возможна и в составе живого вещества. После отмирания
организмов и их минерализации в почве часть этих элементов закрепляется в почве,
другая же часть поступает в природные воды. Возвращаясь в почву, они начинают
новый биогеохимический цикл. В результате процессов выветривания железо в огромных количествах выносится в
океаны. Вынос железа реками в океан происходит в разнообразных формах – в виде
грубых взвесей обломков минералов и пород, содержащих железо в кристаллической
решетке (силикатов, в т.ч. глинистых минералов), в виде коллоидов, содержащих
железо в абсорбированном состоянии, в виде гидратов, гуматов и органических
содинений закисного железа. Недостаток железа приводит у растений к заболеванию, известному под названием
хлороз. Однако непосредственное накопление железа в значительных количествах
характерно лишь для немногих организмов. В этом отношении уникальны
железобактерии, окисляющие двухвалентное железо, в результате чего образуется
лимонит. Диатомовые водоросли способны усваивать железо из нерастворимых
коллоидов. Железо потребляет и зоопланктон с красной кровью (мелкие рачки). При
гибели этих организмов и растворения детритовых частей определенное количество
железа также переходит в раствор в виде гидратов и других форм. В качестве
особых случае концентрации железа организмами можно отметить наличие магнетита и
гетита в в зубах некоторых современных гастропод. Биогеохимический цикл железа и марганца существенно нарушается техногенными
процессами, причем, несмотря на значительно более высокое содержание в земной
коре железа, технофильность этих элементов примерно равна. В ноосфере алюминий
играет исключительно важную роль, но технофильность его почти в 100 раз ниже,
чем у железа. Биогеохимические циклы тяжелых металлов. Тяжелыми металлами обычно называют химические элементы, имеющие атомную массу
более 50 единиц. Несмотря на сравнительно низкую распространенность этих
элементов в природе, они оказывают большое влияние на биогеохимические процессы
в биосфере. Так как многие изних оказывают выраженное токсическое действие на
живые организмы. Многочисленными исследованиями установлено, что наиболее токсичными являются
следующие 9 элементов: Cr, As, Ni, Sb, Pb, Vo, Cd, Hg, Ta. Польские ученые
провели ранжирование тяжелых металлов по потенциалу загрязнения на 4 группы. К
группе элементов с очень высоким потенциалом загрязнения отнесены кадмий, ртуть,
свинец, медь, таллий, олово, хром, сурьма, серебро, золото. К группе элементов с высоким потенциалом загрязнения относятся висмут, уран.
Молибден, барий, марганец, титан, железо, селен, теллур. К группе элементов со
средним потенциалом загрязнения относятся фтор, бериллий, ванадий, рубидий,
никель, кобальт, мышьяк, германий, индий, цезий, вольфрам. Элементы со слабым
потенциалом загрязнения – стронций, цирконий, лантан, ниобий. Как видно, 4 металла из первой группы (с очень высоким потенциалом загрязнения)
– свинец, ртуть, кадмий и хром В известной степени каждый крупный город является причиной возникновения
биогеохимических аномалий, в том числе и опасных для человека. Общеизвестно, что накопление свинца и цинка происходит в зонах интенсивного
движения автотранспорта, вдоль автострад и в индустриальных центрах. Почвы в
сельской местности содержат в 10-20 раз меньше свинца. Чем почвы городов. Свинец
обладает способностью накапливаться в органическом веществе почв. Доступность тяжелых металлов растениям зависит от вида растений, почвенных и
климатических условий. У каждого вида растений концентрации тяжелых металлов
могут варьировать в различных частях и органах, а также зависят от возраста
растений. К почвенным факторам, существенно влияющим на доступность для растений тяжелых
металлов относятся: гранулометрический состав, реакция среды почвы,, содержание
органического вещества, катионообменная способность и дренаж. В более тяжелых
почвах меньшая опасность возможной адсорбции растениями избыточного (токсичного)
количества тяжелых металлов. С повышением рН почвенного раствора возрастает
вероятность образования нерастворимых гидроксидов и карбонатов. Сложилось
мнение, что для снижения до минимума доступности токсичного металла в почве
необходимо поддерживать рН не ниже 6,5. Металлы могут образовывать сложные
комплексные соединения с органическим веществом почвы, и поэтому в почвах с
высоким содержанием гумуса они менее доступны для поглощения растениями.
Обменная емкость катионов зависит, главным образом, от содержания и
минералогического состава глинистой части почв и содержания в них органического
вещества. Чем выше обменная емкость катионов, тем больше удерживающая
способность почв по отношению к тяжелым металлам. Избыток воды в почве способствует появлению в ней металлов с низкой валентностью
в более растворимой форме. Приоритетные загрязнители биосферы – ртуть, свинец, кадмий, цинк, медь.
Увеличение их концентрации в воде, почве, воздухе и биоте является прямым
показателем опасности для животных и человека. |