Модуль 2. Миграции химических элементов в биосфере
и геохимические барьеры
Тема 2.1. ОБЩИЕ ЗАКОНОМЕРНОСТИ МИГРАЦИИ
ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
2.1.1. Среда миграции 2.1.2. Факторы миграции
2.1.3. Миграция элементов в зоне гипергенеза 2.1.4. Виды миграции
Миграция - это процесс перемещения химических элементов в пространстве и во
времени, приводящий к их концентрации или рассеянию. 2.1.1. Среда миграции
Среда миграции может быть твёрдой (диффузия), жидкой (истинные и коллоидные
растворы, расплавы, взвеси или суспензии) или газообразной (газовые смеси,
взвеси, дымы – смесь газа и твердых частиц, аэрозоли, туманы – смесь газа и
частиц жидкости, флюидизаты). Поэтому давайте вспомним что представляют собой истинные и, особенно, коллоидные
растворы, которые нередко возникают в гипергенных условиях. Кроме того, геохимия
биосферы – это прежде всего геохимия реакций, происходящих в присутствии воды.
Вы уже знаете из предыдущих лекций (лекция 3), что вода по целому ряду
аномальных свойств никоим образом не может быть отнесена к обычным жидкостям. Очень многие химические соединения хорошо растворимы в воде и миграция входящих
в их состав элементов происходит в ионной форме (K, Na, Cl и др.), поэтому здесь
необходимо особо остановиться на необычных свойствах воды как растворителя.
Никакая другая жидкость не может сравниться с водой ни по числу веществ, которые
могут в ней растворяться, ни по количеству вещества, которое она может
удерживать в растворе. Объяснение этих замечательных свойств следует искать в
структуре воды, о которой мы говорили ранее (лекция 3). Вы помните, что каждая
молекула воды является миниатюрным диполем. Важным следствием дипольной природы
молекул воды является ее очень высокая диэлектрическая постоянная – 80. Высокая
диэлектрическая проницаемость как раз и объясняет активность воды как
растворителя ионных соединений. Это связано с тем. Что силы притяжения ионов
друг к другу уменьшаются пропорционально диэлектрической проницаемости среды, а
растворение ионных соединений не что иное, как разрыв ионов, составляющих
молекулу растворяемого вещества молекулами растворителя. В растворе катионы
притягивают отрицательные полюсы ближайших диполей молекул воды, а анионы –
положительные полюсы диполей. Этот процесс, как Вам известно из курса химии,
называется гидратацией. Число молекул воды, окружающих каждый ион напрямую
зависит не только от размеров этого иона, но и от плотности заряда на его
поверхности. То есть гидратация иона возрастает с увеличением его заряда (Z) и
убывает с увеличением его радиуса (r). Величина Z/r, называемая ионным
потенциалом, определяет не только гидратацию данного иона, но и многие другие
его свойства в водных растворах. По существу, ионные потенциалы являются мерой
электроотрицательности, т.к. - чем меньше радиус положительного иона и чем
больше его заряд, тем более ярко выражены кислотные свойства соответствующего
окисла. И, наоборот, чем больше радиус и чем меньше заряд, тем сильнее
соответствующее основание. Положительный заряд поверхности иона отталкивает
протоны, входящие в состав молекул воды, координированных вокруг него. Если это
отталкивание достаточно сильно, некоторые из протонов могут отрываться от
молекул воды, в результате чего заряд центрального иона нейтрализуется
образовавшимися гидроксильными группами. В результате – может выпадать в осадок
нерастворимая гидроокись. В истинных растворах элементы присутствуют либо в виде отдельных ионов, либо
входят в состав растворимых комплексных ионов. Вам должно быть известно, что на
растворимость тех или иных соединений существенно влияют и такие параметры
природных вод как их общая минерализация, ионный состав, кислотность-щелочность,
окислительно-восстановительный потенциал. Все эти рассмотренные нами
геохимические параметры вод в первую очередь определяют миграцию химических
элементов в ионной форме. Но в водной среде возможны и иные формы
физико-химической миграции элементов. Одна из таких форм – миграция в коллоидных
растворах. Процесс образования истинных растворов достаточно подробно рассматривается в
курсе химии, поэтому несколько подробнее остановимся на свойствах коллоидных
систем, изучению которых уделяется явно недостаточное внимание в школьном курсе
химии. Коллоидным является такое состояние дисперсной системы, в которой размер диспергированных частиц колеблется приблизительно от 10-3 до 10-6 мм. Нельзя
провести четкой границы между истинными и коллоидными растворами: коллоидные
растворы, с одной стороны, переходят в истинные, а с другой – в суспензии.
Степень их диспергированности такова, что частицы нельзя различить в световом
микроскопе, но они крупнее молекул, т.е коллоидные частицы обычно
мультимолекулярны (состоят из многих молекул). Коолоидные частицы (дисперсная
фаза) разделены дисперсионной средой и в целом составляют коллоидную систему.
Существует большое количество разнообразных типов коллоидных систем: твердое –
газ (дымы), жидкость-газ (туманы), жидкость-жидкость (эмульсии), твердое-жидкость, т.е.
коллоидные растворы (золи, гели и пасты). Жидкость в природныхз коллоидных системах обычно представлена водой.
Коллоидные растворы представляют собой жидкие системы, состоящие из жидкости и
свободно (в процессе броуновского движения) передвигающихся в ней частичек
дисперсной фазы – мицелл. Мицеллы – это не ионизированные атомы, и даже не
отдельные недиссоциированные молекулы, а агрегаты из большого числа
недиссоциированных молекул. С окружающей их жидкостью (дисперсионной средой) они
имеют физические поверхности раздела. В зависимости от соотношения твердой и
жидкой фаз коллоидные растворы подразделяются на золи, гели и пасты.
Золи
представляют собой системы, похожие по своим физическим свойствам на жидкости:
они обладают большой текучестью и сравнительно небольшой вязкостью. Для гелей
характерна повышенная вязкость. Пасты представляют собой системы, в которых
концентрация твердых частиц столь высока, что они заполняют собой почти весь
объем системы. Коллоидные растворы могут быть получены двумя способами: при
дроблении более грубых частиц до коллоидных размеров или, напротив, путем
объединения более мелких частиц (атомов, молекул или ионов). Большинство
природных коллоидов, по-видимому, образуется вторым способом. Есть обширная группа химических элементов, способность которых к миграции в
ионной форме ограничена. Это так называемые элементы-гидролизанты – они в
растворах легко вступают в реакции гидролиза и выпадают в осадок. Это Fe, Mn, Al,
Ti, Sn, Zr, Cr, W, Mo и др. Большей частью они мигрируют в зоне гипергенеза в
форме коллоидных растворов. Их растворимость в коллоидной форме в десятки,
сотни, иногда и в тысячи раз превышает растворимость в форме истинных (ионных)
растворов. Коллоидные частицы электрически заряжены. Происхождение заряда двояко: либо
адсорбция ионов из раствора, либо прямая ионизация вещества частицы. Некоторые
коллоиды, например, гидроокись железа, заряжаются положительно или отрицательно
в зависимости от среды, в которой они образуются. Для наиболее важных коллоидов
характерен заряд:
- Положительные коллоиды – гидроокись алюминия, гидроокись трехвалентного
железа, гидроокись хрома. Гидрат двуокиси тория, гидрат двуокиси титана, гидрат
двуокиси циркония;
- Отрицательные коллоиды – кремнезем, гидроокись двухвалентного железа, гидрат пятиокиси ванадия, гидрат двуокиси марганца, гуминовые коллоиды, сульфидные
золи.
Коллоидное состояние всегда метастабильно. Являясь гетерогенной системой,
коллоидный раствор характеризуется агрегатной неустойчивостью. Им присуща
тенденция к уменьшению свободной энергии мицелл, которая реализуется путём их
слипания и укрупнения. Такой процесс называется коагуляцией коллоидного
раствора. Результат коагуляции – выделение из коллоидного раствора в качестве
самостоятельных фаз гелей (студенистых масс, в которых слипшиеся мицеллы
образуют пространственную «сетку»). Далее может следовать постепенная потеря
этими студенистыми массами содержащейся в них воды, «высыхание». Причины, вызывающие ускорение процесса коагуляции, сложны и многообразны и могут
быть связаны с любыми изменениями физико-химических параметров среды. Одной из
наиболее распространённых причин коагуляции коллоидов в зоне гипергенеза
является смешение коллоидных растворов с истинными, которые действуют на них как
электролиты. Поэтому средой активной миграции коллоидов обычно являются слабо
минерализованные поверхностные и грунтовые воды (пресные и ультрапресные), а
зоной массового осаждения коллоидных частиц – устья рек, т.к. значительная часть
коллоидов быстро коагулирует в морской воде. Область широчайшего распространения
коллоидов – это почвы, где значительная часть минеральных веществ содержится
именно в этой форме. 2.1.2. Факторы миграции
Факторы миграции подразделяются на внутренние и внешние. Внутренние факторы миграции определяются строением атомов. От них зависит
способность элементов давать летучие, растворимые или инертные формы. К ним
относятся:
- электростатические свойства ионов:
- ионный потенциал – отношение заряда иона к его радиусу,
- энергетический коэффициент ионов);
- свойства связи соединений, включая строение кристаллической решетки
(определяют способность соединения противостоять разрушению);
- химические свойства соединений (это уже с учётом условий среды – например,
более высокой устойчивости кислородных соединений в большинстве гипергенных
обстановок);
- гравитационные свойства атомов (проявляются при кристаллизации, седиментации,
выветривании);
- радиоактивные свойства.
Внешние факторы миграции - ландшафтно-геохимические условия, определяющие
поведение элементов в различных химических (окислительно-восстановительных,
щёлочно-кислотных) обстановках:
- температура (в целом повышение ускоряет физико-химическую миграцию, а для
некоторых видов миграции, например, биогенной, нужны определённые диапазоны
температур);
- давление (повышение давления в равновесной системе приводит к изменению
системы в сторону уменьшения объёма);
- степень электролитической диссоциации (зависит от соотношения свойств
растворителя и растворяемого вещества, температуры раствора и его концентрации);
- концентрация водородных ионов, определяющая кислотность-щёлочность среды (pH);
- окислительно-восстановительный потенциал;
- поверхностные силы коллоидных систем (определяют масштабы селективной сорбционности);
- комплексы типоморфных ионов в почвах и водах (что такое типоморфные ионы –
будет рассмотрено далее);
- геоморфологические факторы (рельеф);
- радиационные характеристики среды;
- жизнедеятельность организмов и техногенез – наиболее сложные по механизму
влияния.
Результат миграции – это рассеяние и концентрация химических элементов.
2.1.3. Миграция элементов в зоне гипергенеза
В гипергенных условиях ведущая роль принадлежит миграции в газовой и водной
средах. С учётом этого А.И. Перельманом составлена ещё одна геохимическая классификация
элементов, в которой элементы классифицируются по особенностям их миграции в
гипергенных условиях. (рис. 2.1.1).
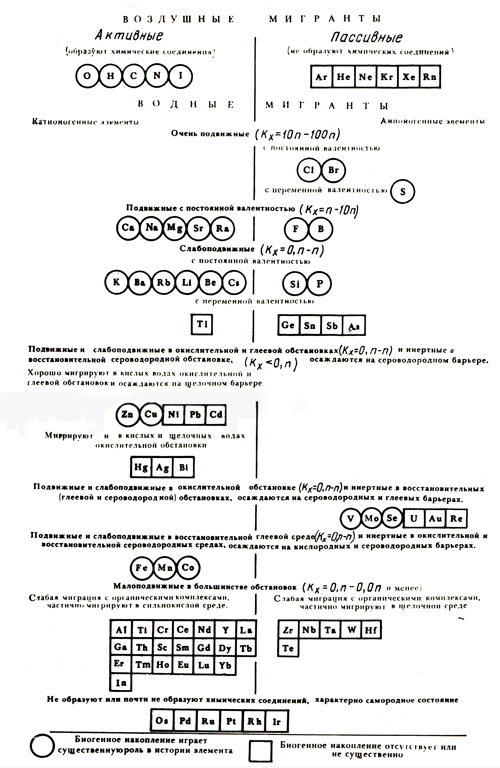
Рис. 2.1.1. Геохимическая классификация А.И. Перельмана по особенностям
миграции
химических элементов в зоне гипергенеза В соответствии с этой классификацией химические элементы подразделяются на
воздушные и водные мигранты Среди воздушных мигрантов, в свою очередь, выделяются:
- активные, образующие соединения (O, H, C, N, I);
- пассивные (все инертные газы).
Водные мигранты – подразделяются, с одной стороны - по степени подвижности и,
кроме того, на катионогенные и анионогенные элементы, т.е. их классификация
имеет табличную (матричную) форму. Подвижность элементов определяется
коэффициентом водной миграции (отношение содержания химического элемента в
минеральном остатке воды к его содержанию во вмещающих породах). KX = (MX/anx)100, где MX – содержание элемента в воде, а – минерализация воды,
nx- содержание
элемента во вмещающей породе. Дополнительные характеристики – постоянная или переменная валентность,
подвижность или же способность осаждаться при различном типе химизма среды,
интенсивность миграции в растворах с различными щелочно-кислотными условиями,
интенсивность миграции с органическими комплексами. В дополнение ко всему
элементы независимо от других признаков подразделяются по роли биогенного
накопления в их миграции (существенная или несущественная). Так что в целом
классификация стройная, но достаточно сложная. 2.1.4. Виды миграции
Разнообразие миграции – определяется числом форм, в которых переносится элемент.
Для химически сходных элементов разнообразнее миграция того из них, у которого кларк выше. Примеры для минералов с кларками одного порядка: S – многовалентна (0, -2, +4,
+6), может входить в состав разнообразных соединений (сульфиды, сульфаты,
органические соединения), образует 369 минеральных видов. Cl – одновалентен,
образует 96 минералов. У Mo – 15 минеральных видов, Hf – 0. Последний пример еще
раз отражает различие между редкими и рассеянными элементами. Виды миграции (или формы движения материи) – выделяются в соответствии с
различными уровнями организации вещества. Выделяются механическая,
физико-химическая, биогенная и техногенная миграция.
- Механическая: перенос без преобразования вещественного состава. Определяется
размерами минеральных частиц, их плотностью, скоростью движения среды,
являющейся агентом переноса (водного потока, ветра и т.д.).
- Физико-химическая: подчиняется физическим и химическим законам. Процессы
диффузии, растворения, осаждения, плавления, кристаллизации, сорбции, десорбции
и т.д. Подвиды – ионная миграция (в растворах), коллоидная, газовая и др.
- Биогенная: определяется деятельностью организмов. Взаимодействие между живым
веществом и инертной материей Земли происходит в форме массообмена химических
элементов между живыми организмами и окружающей средой. Именно процессы
массобмена элементов объективно характеризуют геохимическую деятельность
организмов. Подобные закономерные процессы миграции химических элементов,
осуществляемые не под воздействием геологических факторов, а в результате
жизнедеятельности организмов были названы В.И. Вернадским биогеохимическими.
Здесь учёт лишь химических свойств элементов (валентности, ионных радиусов и
др.) недостаточен. Здесь значительно большую роль приобретают информационные
процессы (иногда не вполне корректно утверждают, что они только на этом уровне и
появляются; но Вы уже знаете, что информация и управление существуют на всех
уровнях организации вещества, только на добиологических уровнях их сложность и
значение несравнимо ниже).
- Техногенная: связана с деятельностью человека. Освоение сырьевых ресурсов,
хозяйственное использование сырья, значительные по масштабам перемещения
вещества, создание веществ, не существующих в природе.
|